비만 약물치료의 최신지견
Recent Advances in Anti-Obesity Drugs
Article information
Trans Abstract
Abstract
Obesity is a chronic, complex, and heterogeneous disease that is affected by genetic, developmental, biological, and environmental factors; thus, it is necessary to approach obesity with an integrated and comprehensive treatment strategy. Because it is difficult to achieve and maintain successful long-term weight loss through lifestyle modifications in most obese patients, a pharmacological approach to the treatment of obesity should be considered as adjuvant therapy. According to the Korean Society for the Study of Obesity guidelines, patients who fail to lose weight with comprehensive lifestyle modifications and who have a body mass index of ≥ 25 kg/m2 are eligible for weight loss medication treatment. Four drugs (orlistat, naltrexone extended-release [ER]/bupropion ER, phentermine/topiramate controlled-release, and liraglutide) have been approved for long-term use (> 12 weeks) to promote weight loss in Korea. Here, I will discuss these currently available anti-obesity agents as well as upcoming anti-obesity agents including semaglutide, setmelanotide, and tirzepatide in terms of obesity management.
서론
비만은 21세기 대표적인 만성질환으로, 고혈압, 당뇨병, 이상지질혈증, 심혈관질환 및 암 발병의 주요 위험요인으로 여겨지고 있다[1]. 이러한 비만 및 복부비만의 유병률은 최근 10년간 꾸준히 증가하여 2019년 기준 국내 성인인구의 30~40% 수준까지 증가하였고[2], 현재 예측 모델에 따르면 유병률은 2030년까지 전 세계적으로 성인 2명 중 1명의 빈도까지 증가할 것으로 예상되고 있다[3].
비만은 유전적, 생리적, 행동적, 사회문화적, 환경적 요인 등 다양한 원인들에 의해 복합적으로 영향을 받아 진행하는 특성을 갖고 있기 때문에, 비만 환자에서 적절한 체중감소와 동반된 질환의 위험도를 낮추기 위해서는 식사요법, 운동요법, 행동요법을 기반으로 한 생활습관교정과 함께 적절한 약물치료 및 수술치료까지 고려하는 통합적이고 포괄적인 접근이 필요하다.
비만약물치료의 원칙
대한비만학회에서 권고하고 있는 약물치료의 지침은 다음과 같다[4]. 1) 비만의 기본적인 치료 방법은, 식사치료, 운동치료 및 행동치료이며, 약물치료는 이들과 함께 시행하는 부가적인 치료방법으로 사용할 것을 권고한다. 2) 체질량지수(body mass index, BMI) 25 kg/m2 이상인 환자에서 비약물치료로 체중감소에 실패한 경우에 약물치료를 고려한다. 3) 장기간 체중관리를 위해서는 대규모 임상연구결과에 기초하여 장기 사용 승인을 받은 약물 처방을 권고한다. 4) 약물치료 시작 후 3개월 내에 5% 이상 체중감소가 없다면 약제를 변경하거나 중단할 것을 권고한다.
일반적으로, 체중을 5~10% 감소시키면 심혈관계 위험인자의 개선 및 당뇨병 발생의 위험을 줄일 수 있어 체중감소의 일반적인 원칙으로 10% 정도의 체중감소와 유지를 비만 치료의 목표로 권고하고 있다. 그러나 실제 생활습관교정의 중재 방식만으로는 장기적인 체중감소 유지가 어려운 부분이 있다. 생리학적으로 체중감소에 따른 식욕억제호르몬인 렙틴(leptin)의 감소와 식욕유발호르몬인 그렐린(ghrelin)의 증가 및 기초대사량 감소는 이전 체중으로 회귀하는 생리학적 적응 환경을 유도하게 된다[5,6]. 이러한 요요현상(yo-yo effect)에 따라 체중감소 후 대개 1년 이내에 감량된 체중의 1/3~2/3가 회복되고 5년 이내에는 95% 이상이 회복되는 것으로 관찰된 바 있다[7]. 따라서 식사요법, 운동요법 등의 비약물요법에도 불구하고 3~6개월 뒤에 기존 체중에서 5% 이상 감소되지 않으면 생활습관 교정과 병행하여 약물치료를 고려해 볼 수 있겠다.
약물치료에 앞서, 환자의 비만도, 비만의 이차적 원인 및 동반질환에 대한 평가와 적절한 치료 목표 설정이 필요하겠다. 비만 약물치료 시에는 체중감소 효과와 함께 의사와 환자 모두 비만 약물치료의 잠재적 부작용에 대해 잘 알고 있어야 하고, 약물치료 시에는 체중감소 효과와 함께 동반질환 및 삶의 질 개선에 대한 부분도 평가가 되어야 한다. 또한 위에서 언급한 바와 같이, 약물 사용 후 3개월 내에 5% 이상의 의미 있는 체중감소가 없다면 새로운 치료전략에 대한 계획이 필요하다.
비만 약물치료의 적응증은, 미국국립보건원에서는 BMI가 30 kg/m2 이상인 경우, 혹은 27 kg/m2 이상이면서 심혈관질환 고위험군(고혈압, 당뇨병, 이상지질혈증)이나 수면무호흡증이 동반된 경우 약물치료를 시도할 것을 권고하고 있다[8]. 아시아-태평양 비만 치료 지침에서는 BMI가 25 kg/m2 이상인 경우, 혹은 23 kg/m2 이상이면서 위와 같은 심혈관질환 고위험인 경우 약물치료를 고려할 것을 제안하였다[9]. 국내에서는 BMI 25 kg/m2 이상인 환자에서 비약물치료로 체중감소에 실패한 경우에 약물치료를 고려하게 된다[4]. 그러나 이러한 권고사항은 현재 미국국립보건원 기준과 동일한 국내 비만 약물 허가사항과 서로 상이하여, 약물 허가사항 외의 상황에서 약물투여를 하고자 하는 경우에는 환자와 충분히 상의하고 약물투여에 따른 이익과 손해에 대해 잘 설명한 후 환자의 동의를 얻고 시행해야 한다.
비만 약물치료의 평가변수와 관련하여 일반적으로 위약군과 비교하여 통계적으로 유의한 5% 이상의 체중감소 효과가 입증되어야 하며, 비만 동반질환의 주요 변수인 혈당조절, 혈압 및 지질 수치의 개선과 함께 치료 1년 후에 35% 이상의 환자가 5% 이상의 체중감소를 달성하여야 효과적인 비만 약물치료로 정의된다[10].
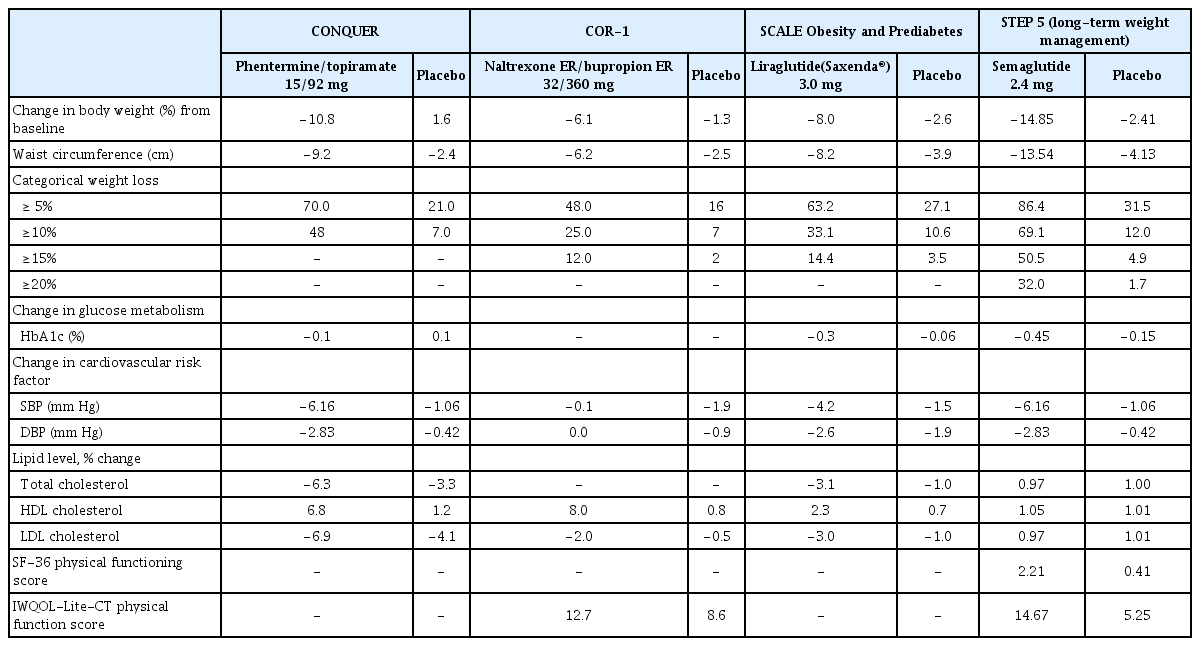
현재 국내에서 장기간 사용허가를 받은 비만 치료제로는 올리스타트(orlistat), 펜터민/토피라메이트(phentermine/ topiramate), 날트렉손/뷰프로피온(naltrexone ER/bupropion ER), 리라글루타이드(liraglutide)가 있다[4]. 로카세린(lorcaserin)의 경우, 종양 발생 위험성 증가로 인해 현재 사용이 불가하다[11]. 본 종설에서는 이 중 펜터민/토피라메이트, 날트렉손/뷰프로피온, 리라글루타이드와 앞으로 소개될 setmelanotide, 세마글루타이드(semaglutide 2.4 mg), tirzepatide의 체중감소와 동반질환 개선에 대한 효과와 안전성에 대해 주로 다루고자 한다(Table 1).
Changes in body weight and cardiometabolic risk factors between baseline and the end of study in anti-obesity drugs
1. 펜터민/토피라메이트(Qsymia®)
Qsymia®는 기존의 단기 식욕억제제인 펜터민과 신경치료제인 토피라메이트 지속형 복합제로, 기존의 두 약제가 사용되던 용량보다 저용량으로 병합하면서 부작용은 줄이고 상승 효과를 통해 체중감소 효과를 높이고자 하는 원칙에 의해 개발된 약제이다. 펜터민은 시상하부에서 노르에피네프린(norepinephrine)의 방출을 증가시키고 시상하부 핵에서의 흡수를 감소시켜 식욕을 억제하고[12], 아드레날린 증가를 통해 에너지소비량을 일부 증가시키는 기전을 통해 체중감소를 유도하는 약제이고[13], 토피라메이트는 간질치료 및 편두통의 예방에 사용되는 약물로 체중감소 기전은 명확하지 않지만 포만감 증가, 에너지소비량 증가, 열량섭취 감소, 미각 이상을 일으켜 체중감소를 유도하는 것으로 밝혀져 있다[14,15]. Qsymia®는 각각 다음과 같은 4가지 용량으로 제공된다: 일일 3.75/23 mg (초기 용량), 7.5/46 mg (최저 치료 용량), 11.25/69 mg 또는 15/92 mg (최대 치료 용량).
1) 효능
5,000명의 과체중 또는 비만한 환자가 참여한 1, 2, 3상 연구를 통해 펜터민/토피라메이트 병용요법의 효능과 안전성이입증된 바 있다. 대표적인 EQUIP 연구는 비만 환자 1,267명이 참여하였으며, 평균 BMI는 42.0 kg/m2였다. 1년 연구 종료 시점에서 초기 용량인 3.75/23 mg에서 3.5%의 체중감소, 최대 치료 용량인 15/92 mg에서 위약군에 비해 9.3%의 체중감소 효과를 보였다[16]. 또 다른 CONQUER (Effects of low-dose, controlled-release, phentermine plus topiramate combination on weight and associated comorbidities in overweight and obese adults) 연구에서는 비만과 동반질환(예: 고혈압, 이상지질혈증, 당뇨병 전단계 또는 당뇨병, 복부비만)을 앓는 2,487명의 환자들을 2:1:2의 비율로 위약, 중간 치료 용량인 7.5/46 mg 또는 최대 치료 용량인 15/92 mg군으로 각각 무작위 배정하였으며, 56주의 연구 종료 시점에서 중간 및 최대 치료 용량군에서 각각 위약 그룹에 비해 6.6% 및 8.6%의 유의한 체중감소가 확인되었다. 5% 이상의 체중감소를 달성한 환자의 비율도 위약군의 21%와 비교하여 중간 치료 용량인 7.5/46 mg군에서는 62%, 최대 치료 용량인 15/92 mg군에서는 70%로 유의하게 높았으며, 이는 10% 이상의 체중감소를 달성한 환자의 비율에서도 유사한 경향성을 보였다(위약: 7%, 7.5/46 mg: 37%, 15/92 mg: 48%) [17]. 또한, CONQUER의 2년 연장 연구(SEQUEL [Two-year sustained weight loss and metabolic benefits with controlled-release phentermine/topiramate in obese and overweight adults])에서도 중간 및 최대 치료 용량군에서 위약군에 비해 각각 7.5% 및 8.7%의 유의한 체중감소 효과가 입증되었다[18].
2) 대사지표에 미치는 영향
EQUIP 및 CONQUER 연구 모두에서 Qsymia® 치료를 받은 환자에서 수축기/확장기혈압, 중성지방 및 고밀도지단백질(high density lipoprotein, HDL) 콜레스테롤이 개선되었다[16,17]. 또한, SEQUEL 연구에서는 공복 혈당과 인슐린 저항성의 개선이 확인되었으며 각 치료군에서 2형당뇨병으로의 진행이 중간 및 최대 치료 용량군에서 각각 54%, 76% 감소한 것으로 나타났다[18]. 비만 약제들 간의 효과 차이를 분석한 네트워크 메타분석 연구에서는 현재 사용되는 비만 치료 약제 중에서 Qsymia®의 체중감소 효과가 가장 큰 것으로 확인되었다[19].
3) 안전성 및 부작용
Qsymia®는 최근 발생한 또는 조절이 불안정한 심혈관질환(예: 관상동맥질환 및 조절되지 않는 고혈압 등)이 동반된 환자에게는 권장되지 않는다[20]. 이러한 병력이 없는 환자의 경우라 하더라도 정기적인 혈압 모니터링과 함께 약물을 복용하는 것이 안전하다. 임신 첫 3개월 동안 Qsymia®를 복용하는 경우 영아에게 구순열 및 구개열이 나타날 위험이 증가한다[21]. 가임기 여성은 해당 약물을 복용하기 전에 반드시 임신 검사를 시행하여야 하고 약제 복용 동안은 피임이 필요하다. 이 약물은 갑상성기능항진증, 녹내장 환자 및 14일 이내에 모노아민 산화효소 억제제를 복용한 환자에게도 처방되어서는 안 된다. 토피라메이트는 신장결석 위험을 증가시킬 수 있으므로 이전에 결석이 있었던 환자에게는 신중하게 처방되어야 한다[22].
Qsymia®는 이상 감각, 현기증, 구강건조, 변비, 미각 상실, 불면증, 불안 등의 부작용을 완화하기 위해 단계적으로 증량할 것이 권장된다. 약물 시작 처음 14일 동안은 일일 3.75/23 mg 용량으로 시작하고 그 후에는 일일 7.5/46 mg 용량을 증량하여 투여를 유지한다. 12주 후에도 기준 체중이 3% 이상 감소하지 않은 경우 14일 동안 11.25/69 mg으로 증량한 다음 일일 15/92 mg으로 증량할 수 있다. 최고 용량을 12주간 투여한 이후에도 체중의 5% 이상 감소되지 않을 경우에는 추가적인 투여를 중단해야 한다. 토피라메이트를 급격하게 중단하는 경우 발작 증세를 유발할 수 있으므로 점진적으로 중단하도록 한다[20].
Qsymia®의 고령자에서의 안전성은 데이터가 충분하지 않다. 간기능 및 신장기능 장애 환자에 대해서는 1일 최대 7.5 mg/46 mg으로 감량하여 투여해야 하며, 중증 이상에서는 이 약의 사용을 피해야 한다. Qsymia® 투여의 심혈관질환에 대한 안전성과 유효성에 관한 대규모 연구는 아직까지 없다.
2. 날트렉손/뷰프로피온(Contrave®)
Contrave®는 뷰프로피온 90 mg과 날트렉손 8 mg으로 이루어진 복합 제제이다. 뷰프로피온은 시상하부에서 멜라노코틴(melanocortin) 경로의 활성화를 촉진하는 도파민과 노르에피네프린의 재흡수를 억제하고[23], 날트렉손은 아편유사제 수용체 길항제로서 뷰프로피온에 의해 활성화된 식욕억제 시상하부 뉴런에서 뮤-오피오이드(mu-opioid) 수용체의 자가 억제 피드백 루프를 감소시켜 뷰프로피온의 체중감소 효과가 유지될 수 있도록 한다[24]. 권장되는 초기 용량은 1일 1정이며, 1일 2회 2정 용량에 도달할 때까지 매주 1정씩 증량한다(1일 최대 용량: 날트렉손 32 mg, 뷰프로피온 360 mg, 투여량: 1주 – 오전 1정, 2주 – 오전 1정, 오후 1정, 3주 – 오전 2정, 오후 1정, 4주 및 이후 – 오전 2정, 오후 2정).
1) 효능
4,536명의 비만 환자를 대상으로 진행된 Contrave Obesity Research (COR)-I, COR-II, COR-behavior modification (BMOD) 및 COR-diabetes (DM)는 Contrave® 관련 대표적인 임상연구이다[25–28]. COR-I, COR-II 및 COR-BMOD 연구에는 BMI 30 kg/m² 이상의 환자 또는 최소 하나의 비만 동반질환이 있는 BMI 27 kg/m² 이상의 환자가 참여하였고[25–27], COR-DM 연구에는 2형당뇨병과 고혈압 또는 이상지질혈증을 동반한 BMI 27 kg/m² 이상의 비만 환자가 참여하였다[28].
56주 동안 수행된 COR-I 연구에서 Contrave® 최대 용량을 투여한 환자군은 대조군의 체중감소 1.3% 대비 평균 체중이 6.1% 유의하게 감소했으며, 5% 이상 체중이 감소한 비율 역시 대조군 16%와 비교하여 48%로 유의하게 높게 나타났다[25]. COR-II 및 COR-DM 연구에서도 이와 유사한 체중감소 효과가 보고되었다. Contrave®를 집중행동요법과 병행하여 투여할 경우, COR-BMOD 결과 대조군에서의 체중감소 5.2%와 비교하여 보다 유의한 9.3%의 체중감소 효과를 확인할 수 있었다[27].
2) 대사지표에 미치는 영향
모든 COR 연구에서 대조군 대비 Contrave® 치료군에서 2차 평가변수인 허리둘레, 내장비만도, HDL 콜레스테롤, 중성지방 수치와 같은 심혈관대사 지표의 유의한 개선이 확인되었다[25–29]. COR-DM 연구에서는 당화혈색소 수치가 대조군 0.1% 대비 약물치료군에서는 0.6%의 유의한 감소를 확인할 수 있었다[28].
3) 안전성 및 부작용
Contrave®의 가장 일반적인 부작용으로는 메스꺼움, 구토, 변비, 두통, 현기증, 불면증, 구강건조증 등이 있다. 아주 드물게 발작이 발생할 수 있다. 이를 예방하기 위해 단계적으로 증량하는 것이 필요하며, 불면증을 고려하여 처음에는 아침에 약제 복용을 하는 것이 적절하다.
또한 조절이 어려운 고혈압, 경련 발작, 폭식증 또는 신경성 식욕부진 병력이 있는 환자에게는 투여에 유의해야 한다. 항정신병용제나 항우울제를 복용 중인 기분장애 및 정신질환 환자의 경우에도 약물상호작용과 발작 위험의 증가로 처방 시 주의가 필요하다[29]. Contrave®는 18~24세에서 자살 충동이나 일부 환자에서 정신신경계 이상반응을 일으킨 사례가 보고된 바 있어 이에 대한 모니터링이 필요하다. 가임기 여성은 해당 약을 복용하기 전에 임신 검사를 받아야 하며 복용하는 동안은 피임을 해야 한다.
Contrave®는 고령자에서 신중히 투여해야 하며 75세 이상에서는 사용하지 않는 것이 좋다. 간기능 및 신장기능장애 환자에 대한 약동학은 충분히 연구되지 않았지만, 간기능장애 환자에서 사용해야 하는 경우에는 최대 하루 1정, 신장기능장애의 경우에는 최대 하루 2정을 투여할 수 있겠다. 하지만 중증의 간기능장애 및 말기 신부전 환자에서는 금기이다. 심혈관질환 안전성에 대한 대규모 연구가 진행된 바 있으나, 연구가 중도에 중단되어 심혈관질환에 대한 효과나 안전성에 대한 결론을 얻을 수 없었다[30].
3. 리라글루타이드(Saxenda®)
Saxenda® 3.0 mg은 성인 비만 치료를 목적으로 2014년 12월에 미국 식품의약국(U.S. Food and Drug Ad-ministration, FDA)의 승인을 받았으며 최근 12~18세 청소년에서도 그 효능이 입증되었다[31]. 리라글루타이드는 glucagon-like peptide-1 (GLP-1)수용체를 활성화시키는 GLP-1유사체로, GLP-1과 97%의 동일성을 보이며 체내에서 장시간 작용하는 것이 특징이다[32]. 말초 부위 피하주사를 통해 체내로 투여된 후 혈관-뇌 장벽을 통과하여 궁상핵을 비롯한 시상하부의 여러 부위에 작용하게 되는데 식욕을 억제하는 프로오피오멜라노코틴/코케인암페타민조절전사물(pro-opiomelanocortin/cocaine-and-amphet-amine-regulated transcript, POMC/CART) 뉴런을 직접적으로 자극하고 GABA (gamma-aminobutyric acid) 신경물질 전달을 통해 식욕을 촉진하는 신경펩타이드Y/아구티관련단백질(neuropeptide-Y/agouti-related protein) 뉴런을 간접적으로 억제하는 역할을 함으로써 식욕을 감소시켜 체중감소 효과를 보이게 된다[33]. 당뇨병이 없는 비만 환자를 대상으로 한 5주간의 초기 임상 연구에서 Saxenda® 3.0 mg/d 투여는 음식 섭취, 공복감 및 위 배출 지연을 억제하는 것으로 확인된 바 있다[34].
1) 효능
Saxenda® 3.0 mg의 비만 치료제 허가 임상인 Satiety and Clinical Adiposity-Liraglutide (SCALE) Obesity and Prediabetes (n =3,731) 및 SCALE-diabetes (n =846) 연구에서는 각각 정상혈당, 당뇨병전단계 및 당뇨병을 동반한 과체중 및 비만 환자에 대한 Saxenda® 3.0 mg의 체중감소 효과를 평가하였다[35,36]. 56주 동안 진행된 연구에서 위약군 대비 유의한 평균 체중감소가 확인되었다(SCALE Obesity and Prediabetes 연구에서 8.0% [위약군: 2.6%], SCALE-diabetes 연구에서 6.0% [위약군 2%]). Saxenda® 3.0 mg의 체중감소 유지 효과는 SCALE-maintenance 연구를 통해 조사되었다. 저칼로리 식단으로 초기 체중의 5%이상을 감량한 422명을 대상으로 56주 동안 Saxenda® 3.0 mg과 위약군으로 각각 무작위 배정하였다. 초기의 평균 체중감소는 6.0%였으며, 연구 종료 시점에서 Saxenda® 3.0 mg 치료군은 위약군 대비 추가적으로 6.2% 체중감소를 달성하였다[37]. 약물치료군에서 각각 5%, 10% 이상의 체중감소목표 달성 비율은 Table 1의 내용과 같다. 비만한 청소년에게서도 Saxenda® 3.0 mg을 투여했을 때 위약군 대비 1차 평가변수인 BMI-Standard Deviation Score의 유의한 감소 효과가 나타난 것으로 보고되었다[31]. 5% 이상의 체중감소 비율은 약물치료군에서 43.3%, 위약군에서 18.7%였고, 10% 이상의 체중감소 비율은 약물치료군과 위약군에서 각각 26.1%, 8.1%로 나타났다[31].
2) 대사지표에 미치는 영향
SCALE Obesity and Prediabetes 연구의 2차 평가 변수에는 허리둘레, 지질, 당화혈색소 및 혈압이 포함되며, 이들 모든 지표는 위약군 대비 상당한 개선을 보였다[35]. 수축기혈압은 각각 Saxenda® 3.0 mg 투여군에서 4.2 mm Hg, 대조군에서 1.5 mm Hg 감소하였으며, 이완기 혈압은 치료군에서 2.6 mm Hg, 대조군에서 1.9 mm Hg 감소하였다. 지질의 경우 중성지방은 치료군에서 13.0 mg/dL, 대조군에서 5.5 mg/dL 감소하였다. Saxenda® 3.0 mg을 투여 받은 대상자는 당뇨병전단계의 빈도와 2형당뇨병의 발병 위험도가 낮게 나타났으며[35], 3년 연장 추가 분석에서도 그 결과는 유지되었다[38]. 비만과 중등증 중증 폐쇄성 수면 무호흡증을 앓는 환자의 경우에도 Saxenda® 3.0 mg 투여는 대조군 대비 무호흡-저호흡지수, 체중, 수축기혈압, 당화혈색소의 유의한 감소를 보였다[39]. SCALE-diabetes 연구에서 당화혈색소 수치는 대조군 대비 Saxenda® 3.0 mg 투여군에서 0.93% 더 낮았고 이전 연구에서와 같이 이상지질혈증의 개선도 확인되었다[36].
Saxenda® 3.0 mg의 심혈관질환에 대한 안전성과 유효성의 직접적인 증거는 아직 없다. 하지만 2형당뇨병에서 승인된 저용량의 리라글루타이드 1.8 mg (Victoza)의 심혈관질환에 대한 안전성은 LEADER (Liraglutide effect and action in diabetes: evaluation of cardiovascular outcome results) 연구에서 입증된 바 있다. 해당 연구에서 평균 3.8년의 추적 기간 동안 리라글루타이드 1.8 mg을 투여한 경우 대조군 대비 주요 심혈관질환의 발생 위험이 13% 감소한 것으로 확인된 바 있다[40].
3) 안전성 및 부작용
Saxenda®의 가장 주된 부작용은 오심, 설사, 변비, 구토 등 소화기계 증상이며, 이러한 부작용을 줄이기 위해 단계적인 증량을 권장한다. 한편 GLP-1수용체작용제들이 급성췌장염을 유발할 수 있다고 알려져 있기 때문에 Saxenda® 사용 시 의심 증상이 발생하면 바로 약제를 중단하고, 췌장염의 과거력이 있는 경우에는 사용하지 않는다. SCALE 연구에서 Saxenda®는 아밀라아제와 리파아제를 각각 7%, 31% 증가시키는 것으로 확인되었고, 췌장염은 대조군(0.1%) 대비 Saxenda®군에서 13명(0.4%)에서 발생하였다. 이들 중 거의 절반은 담석증도 동반되었다[41].
또한 갑상선 수질암과 다발성 내분비 선종증에 대한 우려도 있기 때문에 이에 대한 과거력 또는 가족력이 있는 경우에는 사용하지 않는다[42]. Saxenda®는 혈압과 지질을 개선시키지만 SCALE-diabetes 연구에서는 심박수를 분당 평균 2회 증가시키는 것으로 나타났다[36]. 가임기 여성은 해당 약물을 복용하기 전에 임신 검사를 받아야 하며 복용하는 동안은 피임을 해야 한다. 한편 FDA에서는 Saxenda®를 16주 동안 투여했는데도 체중이 4% 이상 줄지 않으면 약물투여를 중단하도록 권고하였다. 75세 이상의 고령에서는 안전성이 확보되어 있지 않으므로 사용하지 않는 것이 권고된다. 소아 대상의 연구에서도 성인과 유사한 빈도의 부작용 이외 우려할 만한 심각한 부작용은 보고되지 않았다.
4. Setmelanotide (Imcivree®)
Imcivree®는 멜라노코틴4수용체(melanocortin-4-re-ceptor, MC4R)작용제이며 6세 이상 환자에서 POMC, PCSK1 (proprotein convertase subtilisin/kexin type 1)또는 렙틴수용체(leptin receptor, LEPR) 단일 유전자 결핍으로 인한 유전성 비만 치료를 목적으로 2020년 11월 FDA 의 승인을 받았다[43].
에너지과잉으로 지방산 축적이 늘어난 지방세포는 포만감을 유도하는 호르몬인 렙틴의 분비량을 늘린다. 렙틴은 혈액뇌장벽을 통해 시상하부 POMC 뉴런에서 발현되는 LEPR 에 결합한다. 렙틴과의 결합으로 LEPR의 신호경로가 활성화되면, propeptide POMC의 발현을 자극하게 된다. 이후 POMC는 PCSK1에 의해 멜라노코틴 리간드인 알파멜라닌세포자극호르몬(alpha-melanocyte-stimulating hormone)으로 절단되어 MC4R을 자극하여 포만감을 상승시키고 식욕을 억제하게 된다[44]. MC4R 관련 신경회로의 상위 경로에 관여하는 LEPR, POMC 유전자가 결핍되면 폭식증, 사춘기 발달장애, 비만, 인슐린저항성, 부신기능 부전 및 색소침착 등이 나타날 수 있다.
Setmelanotide는 MC4R 신호경로를 활성화하는 물질로, 이를 통해 포만감을 유발하고, 섭식 행동을 중단시킨다. Setmelanotide는 식욕을 감소시키는 것 외에도 에너지소비를 증가시키는 것으로 밝혀져 있다[45]. Imcivree®는 12세 이상 환자의 경우 초기에 일일 2 mg, 6~12세 환자의 경우 일일 1 mg으로 1일 1회 피하 투여하되, 내약성과 그 효능에 따라 1일 최대 3 mg까지 증량할 수 있다.
1) 효능
Imcivree®는 POMC 유전자 결핍(POMC 또는 PCSK1의 동형접합 또는 복합 이형접합) 또는 LEPR 유전자가 결핍된 6세 이상의 환자 21명을 대상으로 한 단일군, 공개 임상, 다기관 3상 연구에서 체중과 식욕을 유의하게 줄이는 효과가 입증됐다[46]. 총 12주간 Imcivree®로 치료 후 약물 효과를 설명하기 위해 8주간 맹검으로 위약을 투약했다. 이어 32주간 Imcivree®를 투약해 총 1년간 치료를 진행했다. 1년 치료 종료 시점에서, 평균 체중감소는 POMC 유전자결핍 환자에서 25.6%, LEPR 유전자결핍 환자에서 12.5%로 나타났다. POMC 유전자결핍 환자 중 80%, LEPR 유전자결핍 비만 환자 중 45%에서는 10% 이상의 유의한 체중감소가 확인되었다.
2) 대사지표에 미치는 영향
Imcivree® 치료 후 POMC 결핍 환자에서 당화혈색소가 0.3%, LEPR 결핍이 있는 환자는 0.2% 감소하였으나 통계적으로 유의하지는 않다. 지질대사와 관련하여서는 Imcivree® 치료 후 POMC 및 LEPR 결핍 그룹에서 HDL 콜레스테롤은 각각 45.0% 및 19.6% 증가, 저밀도지단백질(low density lipoprotein) 콜레스테롤은 7.6% 및 10.0% 감소, 중성지방은 36.6% 및 7.0% 감소하였다[46].
3) 안전성 및 부작용
가장 흔한 부작용으로는 투여 부위 과민반응, 과다색소침착, 구역, 구토 등이 보고되었다. 자살 충동에 대한 우려가 있었으나 3상 연구에서 그와 관련한 부작용 보고는 없었다. 그 외 심각한 이상반응 또는 심혈관계 이상반응은 나타나지 않았다[46].
5. 세마글루타이드(Wegovy®)
Wegovy®는 비만 또는 과체중 성인의 비만 치료제로 2021년 6월 FDA의 승인을 받았다. 세마글루타이드는 GLP-1과 94%의 구조적 상동성을 갖는 GLP-1유사체로 주 1회 피하주사로 투여한다[47]. 약제 시작 용량은 주 1회 0.25 mg이며, 4주 간격으로 증량하여 주 1회 0.5 mg, 1.0 mg, 1.7 mg 및 최대 2.4 mg의 용량으로 투여하게 된다.
1) 효능
Wegovy® 2.4 mg의 비만 치료제 허가 임상인 STEP (Semaglutide treatment effect in people with obesity) 1은 2형당뇨병을 동반하지 않은 1,961명의 비만 또는 과체중 성인 환자를 대상으로 수행되었으며, 68주 연구 종료 시점에서 위약 대비 평균 12.4%의 체중감소 효과가 확인되었다. 5% 이상의 체중감소 목표에 도달한 비율은 약제투여군에서 86.4%, 위약군에서는 31.5%였다[48]. STEP 2는 2형당뇨병을 동반한 1,210명의 비만 또는 과체중 환자를 대상으로 수행되었으며 위약군과 비교하여 평균 6.2%의 체중감소를 보였고, 약제투여군의 68.8%가 5% 이상의 체중감소에 성공하였다(대조군: 28.5%) [49]. STEP 3는 집중행동요법과 함께 Wegovy® 2.4 mg을 투여한 611명의 비만 또는 과체중 환자를 대상으로 수행되었으며 위약군과 비교하여 평균 10.3%의 체중감소를 보였고, 86.6%가 5% 이상의 체중감소에 성공하였다(대조군: 47.6%) [50]. STEP 4에서는 16주간 용량 증량 후 4주 용량을 유지하는 20주의 run-in 기간 이후 달성된 체중감소를 유지하는 데 미치는 Wegovy®의 효능을 평가하였다. 20주간 평균적으로 10.6%의 체중을 감량한 803명의 환자 중 20~68주 사이에 지속적으로 Wegovy® 2.4 mg을 투여한 환자는 추가적으로 7.9%의 체중을 감량한 반면 위약을 투여한 환자는 반대로 6.8%의 체중증가가 나타났다[51].
STEP 6는 국내 환자가 포함된 동아시아의 과체중 또는 비만 환자를 대상으로 수행된 유일한 연구이다. 생활 습관 교정과 함께 주 1회 Wegovy® 2.4 mg 또는 1.7 mg을 투여하였으며, 68주 연구 종료 시점에서 각각의 최대 용량에서 13.2%, 9.6%의 체중감소가 확인되었고, Wegovy® 2.4 mg 군의 82.9% 및 1.7 mg군의 72.4%에서 5% 이상의 유의한 체중감소 효과가 확인되었다. 복부내장지방 면적은 대조군 대비 Wegovy® 2.4 mg 및 1.7 mg군에서 각각 40%, 22% 감소되었고, 심혈관대사 위험요인 역시 개선된 양상을 보였다. 약제의 안전성과 내약성은 다른 GLP-1유사체의 결과에 상응하였다[52].
STEP 8 연구는 338명의 과체중 또는 비만 환자를 대상으로 Wegovy® 2.4 mg과 Saxenda® 3.0 mg을 일대일(head-to-head)로 비교한 무작위배정, 대규모 비교 연구이다. 68주까지의 평균 체중 변화는 Wegovy® 치료군의 경우 15.8%, Saxenda® 치료군의 경우 6.4% 감소로 두 약제 간 통계적으로 유의한 차이를 나타냈다. Wegovy® 치료군에서 10%, 15% 및 20% 이상의 체중감소 도달 비율은 각각 70.9%, 55.6%, 38.5%였고, Saxenda® 치료군에서는 25.6%, 12.0%, 6.0%로 Wegovy® 치료군에서 목표 체중 도달 비율이 유의하게 높게 확인되었다. 치료를 중단한 연구대상자의 비율은 Wegovy® 치료군에서 13.5%, Saxenda® 치료군에서 27.6%였다. 주요 위장관 부작용은 Wegovy® 치료군에서 84.1%, Saxenda® 치료군에서 82.7%로 보고되었다[53].
2) 대사지표에 미치는 영향
STEP 1 연구의 2차 평가 변수에는 허리둘레, 혈압, 지질, C반응단백질, 당화혈색소 및 신체기능점수(36-Item Short Form Survey [SF-36], Impact of Weight on Quality of Life-Lite Clinical Trials Version [IWQOL-Lite-CT])가 포함되었으며, 이들 모두는 위약군 대비 상당한 개선을 보였다[48]. Wegovy® 2.4 mg 치료군에서 수축기혈압은 6.16 mm Hg, 위약군에서 1.06 mm Hg 감소되었으며, 이완기 혈압은 각각 2.83 mm Hg 및 0.42 mm Hg 감소하였다. 당화혈색소의 경우 위약군은 0.17%, Wegovy® 2.4 mg 치료군에서는 0.52%에서 감소했으며 치료군의 84.1%가 68주에 정상혈당에 도달한 반면 위약군의 경우 47.8%만 정상혈당에 도달하였다. STEP 2 연구에서 당화혈색소 수치는 Wegovy® 2.4 mg과 1.0 mg 치료군에서 각각 1.6%, 1.5% 감소하였고, 위약군에서 0.4% 감소된 것으로 확인되었다. 당화혈색소 7.0% 미만에 도달한 비율은 Wegovy® 2.4 mg과 1.0 mg 치료군에서 78.5%, 72.3%였고, 위약군에서는 26.5%로 확인되었다[49].
Wegovy® 2.4 mg의 심혈관질환에 대한 안전성과 유효성 평가에 대한 연구는 진행 중이다(SELECT, NCT03574597). 이전에 수행된 2형당뇨병 환자 대상의 세마글루타이드 1.0 mg (Ozempic®)에 대한 심혈관계 영향 연구인 SUSTAIN-6 (Trial to evaluate cardiovascular and other long-term outcomes with semaglutide in subjects with type 2 diabetes) 연구에서는, 평균 2.1년의 추적 기간 세마글루타이드 1.0 mg 치료군에서 비치명적 심근경색과 뇌졸중에 대한 위험률이 대조군 대비 26% 감소한 것으로 나타났다. 세마글루타이드 1.0 mg 치료군과 위약군 간의 심혈관질환으로 인한 사망률은 유의미한 차이를 나타내지 않았다[54].
3) 안전성 및 부작용
STEP 임상연구에서 확인된 세마글루타이드의 가장 흔한 부작용은 메스꺼움, 설사, 구토 및 변비이다. STEP 1 연구에서 이러한 위장관계 부작용은 세마글루타이드 치료군에서 74.2%, 위약군에서는 47.9%로 나타났다. 이들 대부분은 경증에서 중등도 정도의 증상을 보였으며, 중증의 부작용이 나타난 비율은 세마글루타이드 치료군에서 9.8%, 위약군에서 6.4%로 나타났다. 중증의 이상반응에는 심각한 위장장애(Wegovy® 1.4% 대 위약 0%), 간담도장애(Wegovy® 1.3% 대 위약 0.2%), 담낭장애(Wegovy® 2.6% 대 위약 1.2%) 및 경증 급성췌장염(Wegovy® 0.2% 대 위약 0%)의 빈도로 나타났다. 세마글루타이드 치료군에서 분당 1~4회의 평균 심박수 증가가 확인되었다[48,55]. 2형당뇨병 환자 중 세마글루타이드 치료군의 6.2%, 위약군의 2.5%에서 저혈당이 발생하였다[49]. 리라글루타이드와 마찬가지로 세마글루타이드는 갑상선 수질암 또는 2형 다발성 내분비종양에 대한 가족력이 있는 경우에는 복용이 금기된다. 가임기 여성은 해당 약물을 복용하기 전에 임신 검사를 받아야 하며 복용하는 동안은 피임을 해야 한다. 임신 최소 2개월 전에는 복용을 중단할 것으로 권고하고 있다[55].
6. Tirzepatide
Tirzepatide는 대표적인 트윈크레틴(twincretin)으로 GLP-1과 포도당의존인슐린자극폴리펩타이드(glucose-de-pendent insulinotropic polypeptide, GIP)수용체에 작용하는 이중작용제(dual agonist)이다. 1상 및 2상 연구에서 tirzepatide는 주 1회 최대 15 mg 용량에서 2형당뇨병 환자의 당화혈색소를 최대 2.4%, 체중을 최대 11.3 kg 감소시켰다[56]. Tirzepatide의 효능은 SURPASS 연구를 통해 보고되고 있다[57]. SURPASS-1은 단일요법으로 tirzepatide 를 평가하는 이중맹검 위약 대조 시험으로, 총 40주간 478명의 환자가 위약 및 5 mg, 10 mg, 15 mg 용량의 tirzepatide 치료군에 1:1:1:1로 무작위 배정되었다. 당화혈색소의 위약 보정 감소 값은 tirzepatide 5 mg, 10 mg, 15 mg 치료군에서 각각 1.91%, 1.93%, 2.11%로 나타났다. Tirzepatide 치료군의 87~92%는 당화혈색소 7.0% 미만의 조절 목표에 도달하였다. 또한 tirzepatide 치료군에서는 7.0~9.5 kg의 용량 의존적인 유의한 체중감소가 확인되었다. SURPASS-2는 메트포민(metformin)으로 혈당조절이 충분하지 않은 2형당뇨병 환자 1,879명을 대상으로 tirzepatide와 세마글루타이드를 일대일 비교한 연구이다[58]. 연구대상자는 40주의 치료 기간 동안 매주 5 mg, 10 mg, 15 mg의 tirzepatide를 투여하는 군과 매주 세마글루타이드 1.0 mg을 투여하는 군으로 무작위 배정되었다. 40주 연구 종료 시점에서 평균 당화혈색소는 tirzepatide 5 mg, 10 mg, 15 mg군에서 각각 2.01%, 2.24%, 2.3% 감소한 반면, 세마글루타이드 1.0 mg군에서는 1.86% 감소하였다. 두 치료군 간에는 통계적으로 유의한 차이가 확인되었다. 또한 체중은 tirzepatide 5 mg, 10 mg, 15 mg 군에서 각각 7.6 kg, 9.3 kg, 11.2 kg 감소한 반면 세마글루타이드 1.0 mg군에서는 5.7 kg 감소하였다.
최소 5% 이상 체중이 감소한 비율은 tirzepatide 치료군에서 65~80%, 세마글루타이드 치료군에서 54%였으며, 두 군에서 유사한 빈도의 위장관계 부작용이 관찰되었다. 이러한 부작용은 대부분 일시적이었으며 용량 증량 단계에서 발생하였다. 요약하자면, 이 중 GIP 및 GLP-1작용제는 GLP-1유사체와 비교하여 당화혈색소 및 체중감소에 우월성을 보였을 뿐 아니라 치료 중단 비율도 낮게 나타났다.
SURPASS-3는 매주 5 mg, 10 mg, 15 mg의 tirzepatide 또는 인슐린 데글루덱(degludec) 치료를 받은 1,444명의 환자를 대상으로 한 무작위 공개 임상 시험이다[59]. 52주 연구 종료 시점에서 당화혈색소는 tirzepatide 5 mg, 10 mg, 15 mg군에서 각각 1.93%, 2.20%, 2.37% 감소했으며 인슐린 데글루덱의 경우 1.34% 감소하였다. Tirzepatide 치료군에서 보다 유의한 체중감소가 확인되었지만 위장관계 부작용 발생률은 더 높게 나타났다. 중증의 저혈당 발생 비율은 tirzepatide 치료군에서 1~2%, 인슐린 데글루덱 치료군에서는 7%로 관찰되었다.
향후 발표 예정인 당뇨병이 없는 비만 또는 과체중 성인 환자 대상의 SURMOUNT 연구를 통해 tirzepatide의 체중감소 효과와 그 안전성이 확인될 것으로 예상된다. 그 외 현재 심부전(NCT04847557) 및 비알코올성 지방간염(NCT04166773)에서도 이러한 tirzepatide의 효능을 평가하는 연구가 진행 중이다. 다만, 아시아인을 대상으로 한 임상데이터는 아직 제한적으로, 향후 이에 대한 연구가 진행되어야 할 것이다.
결론
비만은 만성적으로 진행하는 질환으로 이해하는 것이 중요하며, 비만 전단계를 포함하여 현재의 비만도 평가와 향후 진행될 체중의 궤적에 대한 예상과 추적관리가 중요하겠다. 충분한 생활습관교정을 포함한 비약물치료로 유의미한 체중감소 달성이 어렵다면 장기간 사용이 허가된 약물요법을 일차적으로 고려해 볼 수 있겠다. 비만 약물치료 시에는 체중감소와 동반질환의 개선을 위한 장기간의 치료 유지, 개인별로 차이를 보이게 되는 체중감소에 따른 생리학적 적응 과정과 약물반응에 대한 고려, 이와 더불어 삶의 질 개선에 대한 평가도 중요하겠다.
현재 장기간 사용 가능한 약제는 올리스타트, 날트렉손/뷰프로피온, 펜터민/토피라메이트, 리라글루타이드 네 가지 약물로, 식욕을 억제하거나 지방 흡수를 저해하는 작용을 통해 5~10% 범위의 체중감소에 도움을 줄 수 있다. 그러나 체중감소치료의 본질적인 목표는 체중감소량 자체보다는 비만 동반 합병증을 예방 및 치료하여 건강을 증진하고 이환율과 사망률을 줄이는 것이라 할 수 있겠다. 이러한 목표를 달성하기 위해서는 10~15% 이상의 체중감소 및 유지가 필요하고 향후 소개될 2세대 비만 약물치료제인 세마글루타이드를 포함하여 GIP/GLP-1 dual agonists와 GIP/GLP-1/glucagon triagonists 등을 포함한 복합 약제들은 비만 치료의 새로운 패러다임을 가져올 것으로 기대된다[60].