ņä£ļĪĀ
ļŗ╣ļć©ļ│æņØś ņ£äĒŚśņÜöņåīļĪ£ ņŚ¼Ļ▓©ņ¦ĆĻ│Ā ņ׳ļŖö ļ╣äņĢīņĮöņś¼ņä▒ ņ¦Ćļ░®Ļ░äņ¦łĒÖś(non-alcoholic fatty liver disease, NAFLD)ņØĆ ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ļÅä ļ╣äļ¦īņØś ņ”ØĻ░ĆņÖĆ ĒĢ©Ļ╗ś ņ£Āļ│æļźĀņØ┤ ļŖśņ¢┤ļéśĻ│Ā ņ׳ļŗż. ņØĖņŖÉļ”░ ņĀĆĒĢŁņä▒Ļ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦ĆļŖö NAFLDļŖö ņ¦äļŗ©ņØś ņżæņÜöņä▒ņØ┤ ņ╗żņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░, ņØ┤ņŚÉ ļö░ļźĖ ņ╣śļŻīļ▓ĢļÅä ņ¦ĆņåŹņĀüņ£╝ļĪ£ ļ░£Ēæ£ļÉśĻ│Ā ņ׳ļŗż[
1]. ļ│Ė ĻĖĆņŚÉņä£ļŖö ļŗ╣ļć©ļ│æĻ│╝ ĒĢ©Ļ╗ś ļÅÖļ░śļÉśļŖö NAFLD ņØś ņ¦äļŗ© ļ░®ļ▓Ģ ļ░Å ņ╣śļŻīļ▓ĢņŚÉ ļīĆĒĢ┤ ļģ╝ņØśĒĢ┤ļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ņŚŁĒĢÖ ļ░Å ņĀĢņØś
ņĄ£ĻĘ╝ 7ļģäĻ░ä ņÜ░ļ”¼ļéśļØ╝ņØś ļŗ╣ļć©ļ│æ ņ£Āļ│æļźĀ(2018ļģä Ēśäņ×¼ 15.9%)ņØĆ ņä▒ļ│äņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æņØĆ ņØĖņŖÉļ”░ ņĀĆĒĢŁņä▒, ļ╣äļ¦īĻ│╝ ņŚ░Ļ┤ĆļÉśļŖö NAFLD, ņŗ¼ĒśłĻ┤Ćņ¦łĒÖś, ļīĆņé¼ņ”ØĒøäĻĄ░Ļ│╝ Ļ╣ŖņØĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗż[
1]. NAFLDļŖö ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æņØś ņ£äĒŚśņØĖņ×ÉņØ┤ļ®░, ļŗ╣ļć©ļ│æĒÖśņ×ÉņØś NAFLD ņ£Āļ│æļźĀ ļśÉĒĢ£ ļåÆļŗż. ņĄ£ĻĘ╝ ĒĢ£ĻĄŁņØĖņØś ļ╣äļ¦ī ņĀĢļÅäĻ░Ć ņŗ¼ĒĢ┤ņ¦Ćļ®┤ņä£ NAFLD ņ£Āļ│æļźĀņØĆ 30% ņĀĢļÅä ļÉśļŖö Ļ▓āņ£╝ļĪ£ ņČöņĖĪĒĢśĻ│Ā ņ׳ļŗż. ĒŖ╣Ē׳ ļŗ╣ļć©ļ│æĒÖśņ×ÉņÖĆ ļŗ╣ļć©ļ│æņØ┤ ņŚåļŖö ņØ╝ļ░śņØĖĻ│╝ņØś NAFLD ņ£Āļ│æļźĀņØĆ 2ļ░░ņØś ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż(39% vs 19%) [
2,
3]. ņ¦Ćļ░®ņØś ļČäĒĢ┤ļĪ£ ĒśłņĢĪ ļé┤ ņ¦Ćļ░®ņé░ņØś ļåŹļÅäĻ░Ć ļåÆņĢäņ¦Éņ£╝ļĪ£ņŹ© ņØ┤ļŖö Ļ░ü ņןĻĖ░ņŚÉ ņČĢņĀüļÉśņ¢┤ ņŚ╝ņ”ØņØä ņØ╝ņ£╝ĒéżĻ▓ī ļÉśļŖöļŹ░[
4], ņĘīņןņØś ļ▓ĀĒāĆņäĖĒżņŚÉļÅä ņ£Āļ”¼ņ¦Ćļ░®ņé░ņØ┤ ņČĢņĀüļÉśņ¢┤ ņØĖņŖÉļ”░ ļČäļ╣äļŖźņØä Ļ░Éņåīņŗ£Ēé┤ņ£╝ļĪ£ņŹ© ļŗ╣ļć©ļ│æ ļ░£ņāØņŚÉ ņśüĒ¢źņØä ņżĆļŗż. NAFLDļŖö ņ¦Ćļ░®ņØ┤ Ļ░äņĪ░ņ¦üņØś 5% ņ┤łĻ│╝ ņČĢņĀüļÉśĻ│Ā, ņĢīņĮöņś¼ņØä ļé©ņä▒ņØĆ ĒĢśļŻ© 30 g, ņŚ¼ņä▒ņØĆ 20 g ļ»Ėļ¦ī ļ¦łņŗż ļĢīļĪ£ ņĀĢņØśļÉ£ļŗż[
2]. NAFLDļŖö ņŚ╝ņ”ØņØ┤ļéś ņä¼ņ£ĀĒÖö ļ░śņØæņØ┤ ņŚåņØ┤ ņ¦Ćļ░®ļ¦ī ņ╣©ņ░®ļÉśļŖö ļŗ©ņł£ ņ¦Ćļ░®Ļ░ä(simple steatosis)ņŚÉņä£ Ļ░äņäĖĒżņØś ballooning ļ│Ćņä▒ ļ░Å apoptosis, Ļ░äņŚĮ ļé┤ ņŚ╝ņ”Øņ╣©ņ£ż ņåīĻ▓¼ņØä ļ│┤ņØ┤ļ®░, ņä¼ņ£ĀĒÖöļź╝ ļ│┤ņØ╝ ņłśļÅä ņ׳Ļ│Ā ņĢäļŗÉ ņłśļÅä ņ׳ļŖö ļ╣äņĢīņĮöņś¼ņä▒ ņ¦Ćļ░®Ļ░äņŚ╝(nonalcoholic steatohepatitis, NASH), ĻĘĖļ”¼Ļ│Ā ļ╣äĻ░ĆņŚŁņĀü ņä¼ņ£ĀĒÖöņŚÉ ņØśĒĢ£ Ļ░äĻ▓ĮĒÖöļĪ£ ņ¦äĒ¢ēļÉśļŖö Ļ░äņ¦łĒÖśņØä ĒżĻ┤äĒĢśļŖö ņ¦łļ│æņØ┤ļŗż. ļŗ©ņł£ ņ¦Ćļ░®Ļ░äņØś Ļ▓ĮņÜ░ ļīĆļČĆļČä ņ╣śļŻī ņŚåņØ┤ ņĀĆņĀłļĪ£ ĒśĖņĀäļÉśņ¦Ćļ¦ī, ņØ╝ļČĆļŖö NASH ļĪ£ ļ░£ņĀäĒĢ£ļŗż[
1].
ņ¦äļŗ©
NAFLDņØś ņśłĒøäļŖö ņ¦Ćļ░®Ļ░äņŚ╝ņØś ņĀĢļÅä ļśÉļŖö ņä¼ņ£ĀĒÖöņØś ņĀĢļÅäņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ņ¦Ćļ®░ ņØ┤ļź╝ ĒÖĢņØĖĒĢśļŖö Ļ░Ćņן ņóŗņØĆ ļ░®ļ▓ĢņØĆ Ļ░ä ņāØĻ▓ĆņØ┤ļŗż. NASHņØś Ļ▓ĮņÜ░ ņ╣©ņŖĄņĀüņØĖ Ļ░ä ņāØĻ▓ĆņØ┤ ņĢäļŗī ļŗżļźĖ Ļ▓Ćņé¼ ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļŗ©ņł£ ņ¦Ćļ░®Ļ░äĻ│╝ Ļ░Éļ│äĒĢśļŖö Ļ▓āņØĆ Ēלļōżņ¦Ćļ¦ī, Ļ░ä ņāØĻ▓ĆņØĆ ĒĢ®ļ│æņ”ØņØś ļ░£ņāØ Ļ░ĆļŖźņä▒ ļ░Å ļ╣äņÜ®ņāüņØś ļ¼ĖņĀ£ļĪ£ ĒśäņŗżņĀüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢśĻĖ░Ļ░Ć ņēĮņ¦Ć ņĢŖļŗż. Ļ░ä ņāØĻ▓Ć ņŗ£ņŚÉļŖö Ēæ£ļ│Ėņśżņ░©Ļ░Ć ņĪ┤ņ×¼ĒĢĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ņČ®ļČäĒĢ£ ņ¢æņØś ņĪ░ņ¦üņØä ļæÉ ĻĄ░ļŹ░ ņØ┤ņāüņŚÉņä£ ņ▒äņĘ©ĒĢśļŖö Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż. ļŗżļ¦ī Ļ▓Ćņé¼ņ×É ņé¼ņØ┤ņŚÉ, Ēś╣ņØĆ Ļ░ÖņØĆ Ļ▓Ćņé¼ņ×ÉļØ╝Ļ│Ā ĒĢśļŹöļØ╝Ļ│Ā ņ¦äļŗ©ņØ┤ ļČłņØ╝ņ╣śĒĢśļŖö Ļ▓ĮņÜ░ļÅä ņ׳ņØä ņłś ņ׳ļŗż[
5].
ļŗ©ņł£ ņ¦Ćļ░®Ļ░ä ļ░Å Ļ░äņä¼ņ£ĀĒÖö ņ¦äļŗ©ņØä ņ£äĒĢ£ ļ╣äņ╣©ņŖĄņĀüņØĖ ļŗżņ¢æĒĢ£ ļ░®ļ▓ĢņØä Ēæ£ļĪ£ ņĀĢļ”¼ĒĢśņśĆļŗż(
Tables 1,
2) [
2,
5].
Table┬Ā1.
Summary of biomarker-based prediction models to assess hepatic steatosis
|
Indices |
Equations |
Cut-points |
Development cohort |
External validation |
|
FLI |
= 1 / [1 + exp (-Y)] ├Ś 100, Y = 0.953 ├Ś loge (TG, mg/dL) + 0.139 ├Ś BMI + 0.718 ├Ś loge (GGT, U/L) + 0.053 ├Ś WC - 15.745 |
Ōēź 60, < 30 |
NAFLD by US (Italy) |
Yes (validated in Korean) |
|
SteatoTest |
╬▒2-Macroglobulin, haptoglobin, apolipoprotein A1, total bilirubin, GGT, FPG, TG, cholesterol, ALT, age, sex, BMI |
NA |
NAFLD by biopsy (France) |
Yes |
|
NAFLD liver fat score |
= -2.89 + 1.18 ├Ś MetS + 0.45 ├Ś diabetes (yes = 2, no = 0) + 0.15 ├Ś (fSinsulin, ┬ĄU/L) + 0.04 ├Ś AST - 0.94 ├Ś AST/ALT |
> -0.64 |
NAFLD by MRS (Finland) |
Yes (validated in Korean) |
|
HIS |
= 8 ├Ś ALT/AST + BMI (+2, if diabetes; +2, if female) |
Ōēź 36, < 30 |
NAFLD by US (Korean) |
Yes (validated in Korean) |
|
CNS |
= 1 / [1 + exp (-Y)] ├Ś 100 Y (male) = 0.016 ├Ś age + 0.182 ├Ś BMI + 0.089 ├Ś WC + 0.391 ├Ś alcohol + 0.124 ├Ś exercise (yes = 0, no = 1) + 0.018 ├Ś FPG (mg/dL) + 0.773 ├Ś loge (TG, mg/dL) - 0.014 ├Ś HDL-C (mg/dL) + 0.145 ├Ś uric acid (mg/dL) - 0.674 ├Ś loge (AST) + 1.632 ├Ś loge (ALT) - 21.695 Y (female) = 0.320 ├Ś BMI + 0.044 ├Ś WC + 0.533 ├Ś diabetes + 0.016 ├Ś FPG + 0.951 ├Ś loge (TG) - 0.015 ├Ś HDL-C + 0.199 ├Ś uric acid - 0.645 ├Ś loge (AST) + 1.302 ├Ś loge (ALT) + 0.255 ├Ś menopause - 19.741 |
Ōēź 40 |
NAFLD by US (Korean) |
Yes (validated in Korean) |
|
SNS |
= points, age Ōēź 35 = 1 WC (male) = 80-89/90-99/Ōēź 100 = 2/3/4 WC (female) = 75-84/85-94/Ōēź 95 = 1/2/3 BMI (male) = 23-24/25-26/Ōēź 27 = 1/2/3 BMI (female) = 23-24/25-26/Ōēź 27 = 2/3/4 Diabetes = 2 Dyslipidemia = 2 No regular exercise = 1 Alcohol = 1 for male Menopause = 1 for female |
Ōēź 8 |
NAFLD by US (Korean) |
Yes (validated in Korean) |
|
ZJU index |
= BMI + FPG (mmol/L) + TG (mmol/L) + 3 ├Ś ALT/AST (+2, if female) |
> 38, < 32 |
NAFLD by US (China) |
Yes |
|
FSI |
= -7.981 + 0.011 ├Ś age (y) - 0.146 ├Ś sex (female = 1, male = 0) + 0.173 ├Ś BMI + 0.007 ├Ś TG (mg/dL) + 0.593 ├Ś hypertension + 0.789 ├Ś diabetes + 1.1 ├Ś ALT/AST ratio Ōēź 1.33 (yes = 1, no = 0) |
Ōēź 23 |
NAFLD by CT (USA) |
Yes |
|
Chinese NAFLD score |
= -4.632 + 0.303 ├Ś MetS + 0.157 ├Ś T2DM (yes = 2, no = 0) + 0.078 ├Ś fSinsulin (┬ĄU/L) + 0.168 ├Ś BMI - 0.879 ├Ś AST/ALT |
> -0.79 |
NAFLD by US (China) |
Yes |
Table┬Ā2.
Summary of biomarker-based prediction models to assess hepatic fibrosis
|
Indices |
Equations |
Cut-points for advanced fibrosis (F3) |
Development cohort |
External validation in NAFLD |
|
NFS |
= -1.675 + 0.037 ├Ś age (y) + 0.094 ├Ś BMI (kg/m2) + 1.13 ├Ś IFG/diabetes (yes = 1, no = 0) + 0.99 ├Ś AST/ALT ratio - 0.013 ├Ś platelet (├Ś109/L) - 0.66 ├Ś albumin (g/dL) |
> 0.676, < -1.455 |
NAFLD by biopsy (Caucasian 90%) |
Yes (validated in Korean) |
|
FIB-4 |
= age (y) ├Ś AST (U/L) / [platelet (109/L) ├Ś (ALT [U/L])1/2] |
> 2.67 or 3.25 |
HIV/HCV by biopsy (International, Caucasian 77%) |
Yes (validated in Korean) |
|
ELF test |
ELF = -7.412 + 0.681 ├Ś loge (hyaluronic acid) + 0.775 ├Ś loge (procollagen III N-terminal peptide) + 0.494 ├Ś loge (tissue inhibitor of metalloproteinase 1) + 10
ELF + simple markers panel = -20.870 + 5.506 ├Ś ELF 4.513 ├Ś diabetes/IFG - 3.144 ├Ś AST/ALT - 0.058 ├Ś BMI - 0.026 ├Ś platelet (109/L) 0.639 ├Ś albumin (g/dL) |
Ōēź 10.51 |
NAFLD by biopsy (Caucasian) |
Yes (validated in viral liver diseases, Korean) |
|
FibroTest |
Age, sex, total bilirubin, GGT, apolipoprotein A1, haptoglobin, and ╬▒2-macroglobulin |
Ōēź 0.30 or 0.60 |
HCV by biopsy (France) |
Yes (validated in viral liver diseases, Korean) |
|
APRI |
= AST (IU/L)/AST upper limit of normal (IU/L)/platelet (109/L) |
> 1.5, < 0.5 |
HCV by biopsy (USA) |
Yes (validated in viral liver diseases, Korean) |
|
BARD score |
AST/ALT ratio Ōēź 0.8 = 2 points BMI Ōēź 28 = 1 point Presence of diabetes = 1 point |
Ōēź 2 |
NAFLD by biopsy (USA) |
Yes (validated in Korean) |
|
Hepascore |
= Y / (1 + Y) Y = exp (-4.185818 - 0.0249 ├Ś age + 0.7464 ├Ś sex + 1.0039 ├Ś ╬▒2-macroglobulin + 0.0302 ├Ś hyaluronic acid + 0.0691 ├Ś bilirubin - 0.0012 ├Ś GGT) |
Ōēź 0.5 |
HCV by biopsy (Australia) |
No |
|
FibroMeter NAFLD |
= 0.4184 ├Ś FPG (mmol/L) + 0.0701 ├Ś AST (UI/L) + 0.0008 ├Ś ferritin (┬Ąg/L) - 0.0102 ├Ś platelet (G/L) - 0.0260 ├Ś ALT (UI/L) + 0.0459 ├Ś body weight (kg) + 0.0842 ├Ś age (y) + 11.6226 |
> 0.490: significant fibrosis (F2) |
NAFLD by biopsy (France) |
No |
NASH ņ¦äļŗ© ļ░®ļ▓Ģņ£╝ļĪ£ aminotransferase ņĖĪņĀĢņØ┤ ņ׳ņØä ņłś ņ׳ņ£╝ļéś ņĀĢĒÖĢļÅäļŖö ņāüļŗ╣Ē׳ ļé«ļŗż. ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ņżæ Ļ░äņäĖĒż apoptosisļź╝ ļ░śņśüĒĢśļŖö ļ░öņØ┤ņśżļ¦łņ╗żņØĖ cytokeratin-18 ļČäņĀł(fragment)ņØĆ NASH ņ¦äļŗ©ņØä ĒĢĀ ņłś ņ׳ļŖö ņ£ĀņØ╝ĒĢ£ markerļĪ£ ļ░ØĒśĆņ¦ä ļ░ö ņ׳ņ£╝ļéś, ņ£ĀņØśĒĢśĻ▓ī ņ¦äļŗ©ņØä ņ£äĒĢ£ ļ░öņØ┤ņśżļ¦łņ╗żļĪ£ ņō░ĻĖ░ņŚÉļŖö ņŚ¼ņĀäĒ׳ ļ¼┤ļ”¼Ļ░Ć ņ׳ļŗż[
5].
ņśüņāüĒĢÖņĀüņ£╝ļĪ£ ņ¦Ćļ░®Ļ░ä(steatosis)ņØä ņ¦äļŗ©ĒĢśļŖö ļ░®ļ▓Ģņ£╝ļĪ£ļŖö ņ┤łņØīĒīīĻ░Ć Ļ░Ćņן ņóŗņØĆ ļ░®ļ▓ĢņØ┤ļéś Ļ░äņä¼ņ£ĀĒÖö ņĖĪņĀĢņŚÉļŖö ņĀ£ĒĢ£ņĀÉņØ┤ ņ׳ņ¢┤, ņ¦Ćļ░®Ļ░äĻ│╝ Ļ░äņä¼ņ£ĀĒÖöļź╝ ļÅÖņŗ£ņŚÉ ņĖĪņĀĢĒĢśļŖö ņĀ£ņ¢┤Ļ░ÉņćĀļ¦żĻ░£ļ│Ćņłś(controlled attenuation parameter, CAP)ņÖĆ magnetic resonance imaging (MRI) ņĖĪņĀĢņØ┤ ĻČīĻ│ĀļÉ£ļŗż[
2,
6]. ņ┤łņØīĒīī, computed tomography (CT)ņÖĆ Ļ░ÖņØĆ ņśüņāüĒĢÖņĀüņØĖ ļ░®ļ▓Ģņ£╝ļĪ£ NASH ņ¦äļŗ©ņØä ņŗ£ļÅäĒĢ┤ļ│┤Ļ│Āņ×É ĒĢśļŖö ņŗ£ļÅäĻ░Ć ņ׳ņŚłņ£╝ļéś ņØ┤ ņŚŁņŗ£ ņĀĢĒÖĢļÅäļŖö ļ¢©ņ¢┤ņ¦äļŗż. ņ▓½ņ¦Ė, ņ┤łņØīĒīīņØś Ļ▓ĮņÜ░ ļ╣äĻĄÉņĀü ņēĮĻ▓ī ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ņ£╝ļéś ņżæļō▒ļÅä ņØ┤ĒĢśņØś Ļ▓ĮņÜ░ ņ×¼Ēśäņä▒ņØ┤ ļé«Ļ│Ā ņĀĢļ¤ēĒÖöĻ░Ć ņ¢┤ļĀżņÜ┤ ļŗ©ņĀÉņØ┤ ņ׳ņ¢┤ ņ┤łĻĖ░ ņ¦äļŗ© ņŗ£ņŚÉ ņĀ£ĒĢ£ņĀüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢśĻ▓ī ļÉĀ Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż. ļæśņ¦Ė, CTņØś Ļ▓ĮņÜ░ņŚÉļŖö MRIņŚÉ ļ╣äĒĢ┤ ļ╣äņÜ®ņØĆ ņĀĆļĀ┤ĒĢśĻ│Ā ņ┤łņØīĒīīņÖĆ ļŗżļź┤Ļ▓ī ņĀĢļ¤ēĒÖöĻ░Ć ņØ╝ļČĆ Ļ░ĆļŖźĒĢ£ ņןņĀÉņØ┤ ņ׳ņ£╝ļéś ļ░®ņé¼ņäĀ ņĪ░ņé¼ļ¤ēņŚÉ ļīĆĒĢ£ Ļ│ĀļĀżĻ░Ć ĒĢäņÜöĒĢśņŚ¼ ņ×äņāüņŚÉņä£ļŖö Ļ░äļé┤ ņ¦Ćļ░®ļ¤ēņØś ņĖĪņĀĢņØä ņ£äĒĢ┤ ļŗ©ļÅģņ£╝ļĪ£ CT Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓ĮņÜ░ļ│┤ļŗżļŖö Ļ▒┤Ļ░ĢĻ▓Ćņ¦äņØ┤ļéś ļŗżļźĖ ņ¦łĒÖśņØś ņ¦äļŗ© ļ¬®ņĀüņ£╝ļĪ£ CT ļź╝ ņŗ£Ē¢ēĒĢĀ Ļ▓ĮņÜ░ ļČĆĻ░ĆņĀüņ£╝ļĪ£ Ļ░äļé┤ ņ¦Ćļ░®ļ¤ēņØś ņĖĪņĀĢņØä ņŗ£Ē¢ēĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ│┤ļŗż ļ¦ÄņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. Ļ░äĻ│╝ ļ╣äņןņØś Hounsfield unit (HU)ņØś ļ╣äņ£© ļśÉļŖö Ļ░äĻ│╝ ļ╣äņןņØś HU ņ░©ņØ┤ļź╝ ņĖĪņĀĢĒĢśņŚ¼ HUĻ░Ć ņĖĪņĀĢ ņ£äņ╣śņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ņ¦ĆļŖö ļŗ©ņĀÉņØä ļ│┤ņÖäĒĢĀ ņłś ņ׳ļŗż. Ļ░ä/ļ╣äņן HU ļ╣äņ£©ņØ┤ 0.9 ņØ┤ĒĢśņØĖ Ļ▓ĮņÜ░ Ļ░äļé┤ ņ¦Ćļ░®ņ╣©ņ░®ņØ┤ ņ׳ļŗżĻ│Ā Ļ░äņŻ╝ĒĢśļ®┤ ļÉ£ļŗż. ņģŗņ¦Ė, magnetic resonanceļź╝ ņØ┤ņÜ®ĒĢ£ MRIņÖĆ MRS (magnetic resonance spectroscopy)Ļ░Ć ņ׳ļŗż. Ļ░äņĀæņĀüņ£╝ļĪ£ Ļ░ä ļé┤ļČĆņØś ņ¦Ćļ░®ļ¤ēņØä ņĖĪņĀĢĒĢśļŖö ņ┤łņØīĒīī, CTņÖĆ ļŗżļź┤Ļ▓ī MR ņØĆ ņ¦üņĀæņĀüņ£╝ļĪ£ Ļ░ä ļé┤ļČĆņØś ņ¦Ćļ░®ļ¤ēņØä ņĖĪņĀĢĒĢ£ļŗż. ļåÆņØĆ ļ»╝Ļ░ÉļÅäņÖĆ ņśłļ»╝ļÅäļĪ£ ņ╣śļŻī ņĀäĒøä Ļ░äņŗżņ¦łņØś ņ¦Ćļ░®ļ¤ēņØä ņĖĪņĀĢĒĢĀ ņłś ņ׳ņ¢┤ ļŗ╣ļć©ļ│æĒÖśņ×ÉņŚÉĻ▓īļÅä ņé¼ņÜ®ĒĢĀ ņłś ņ׳ņ£╝ļéś, Ļ│ĀĻ░ĆņØś ļ╣äņÜ®, ņłÖļĀ©ļÉ£ ņØśļŻīņ¦äņØ┤ ĒĢäņÜöĒĢśļŗżļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż. ļäĘņ¦Ė, ņĀ£ņ¢┤Ļ░ÉņćĀļ¦żĻ░£ļ│ĆņłśļŖö transient elastography (FibroScan
Ōōć)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Ļ░äņŗżņ¦łņŚÉ ņ¦Ćļ░® ņ╣©ņ░®ņØ┤ ļ¦ÄņØäņłśļĪØ ņ┤łņØīĒīīņØś ņ¦äĒÅŁņØ┤ Ļ░ÉņåīĒĢśļŖö ņĀĢļÅäĻ░Ć ņŗ¼ĒĢ┤ņ¦äļŗżļŖö ņĀÉņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ░ä ļé┤ļČĆņØś ņ¦Ćļ░® ņ╣©ņ░® ņĀĢļÅäļź╝ ņĖĪņĀĢĒĢ£ļŗż. SteatosisņØś ņĀĢļÅäņŚÉ ļö░ļØ╝ S0ņØś Ļ▓ĮņÜ░ CAP 205 dB/m, S1ņØś Ļ▓ĮņÜ░ 245 dB/m, S2ļŖö 299 dB/m, S3ļŖö 321 dB/mņØś ņżæĻ░äĻ░ÆņØä ļ│┤ņśĆļŗż. CAP 250 dB/m ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ ņ¦Ćļ░®Ļ░äņØ┤ ņ׳ņØīņØä ņØśļ»ĖĒĢśļ®░, 300 dB/m ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ ņżæļō▒ļÅäņØś ņ¦Ćļ░®Ļ░äņØ┤ ņ׳ņØīņØä ņØśļ»ĖĒĢ£ļŗż. CAPĻ░Ć ņØĖņŖÉļ”░ ņĀĆĒĢŁņä▒Ļ│╝ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżļŖö ņé¼ņŗżĻ│╝ ļŗ╣ļć©ļ│æņØ┤ ņ׳ļŖö ĒÖśņ×ÉņØś CAP ņłśņ╣śĻ░Ć ļŗ╣ļć©ļ│æņØ┤ ņŚåļŖö ĒÖśņ×ÉņØś ņłśņ╣śļ│┤ļŗż ļåÆļŗżļŖö ņĀÉ, ņĀĢļ¤ēĒÖö Ļ░ĆļŖźĒĢśņŚ¼ Ļ▓Ćņé¼ņ×ÉņŚÉ ņØśņĪ┤ņĀüņØ┤ņ¦Ć ņĢŖļŗżļŖö ņĀÉ, ļ╣äņÜ®ņØ┤ ņĀĆļĀ┤ĒĢśļŗżļŖö ņĀÉ ļĢīļ¼ĖņŚÉ FibroScan
ŌōćņØ┤ ņĄ£ĻĘ╝ ļ¦ÄņØ┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. Ļ░ä ņä¼ņ£ĀĒÖöļŖö FibroScan
ŌōćņØä ņØ┤ņÜ®ĒĢśņŚ¼ LSM (liver stiffness measurement)ņØä ĒåĄĒĢ┤ ņĀĢļ¤ēņĀüņ£╝ļĪ£ ņĖĪņĀĢĒĢĀ ņłś ņ׳ļŗż.
Fig. 1ņØĆ ļīĆĒĢ£ļŗ╣ļć©ļ│æĒĢÖĒÜī ņ¦Ćļ░®Ļ░äņŚ░ĻĄ¼ĒÜīņŚÉņä£ NAFLDļź╝ ļÅÖļ░śĒĢ£ ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æĒÖśņ×ÉņŚÉņä£ņØś ņ¦äļŗ©ņØä ņ£äĒĢ£ ņĀæĻĘ╝ ļŗ©Ļ│äļź╝ ņÜöņĢĮĒĢ£ ĻČīĻ│ĀņĢłņØ┤ļŗż[
1].
Fig.┬Ā1.
Algorithm for non-alcoholic fatty liver disease (NAFLD) evaluation. Adapted from the article of Lee et al. (Diabetes Metab J 2020;44:382-401) [
1] in accordance with the Creative Commons Attribution Non-Commercial (CC BY-NC 4.0) license.
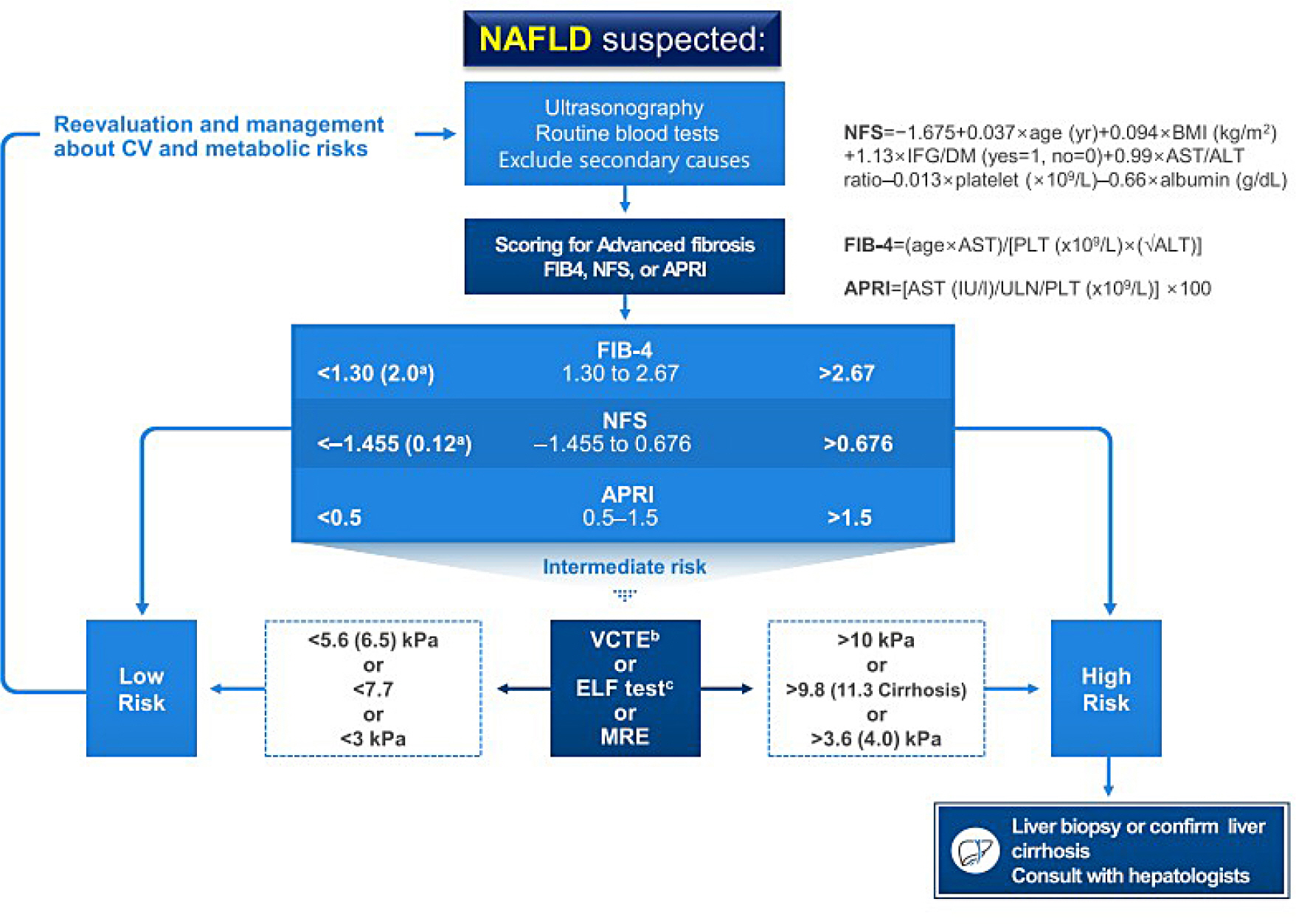
CV, cardiovascular; NFS, NAFLD fibrosis score; BMI, body mass index; IFG, impaired fasting glucose; DM, diabetes mellitus; AST, aspartate aminotransferase; ALT, alanine aminotransferase; FIB-4, fibrosis-4; PLT, platelet; APRI, AST to platelet ratio index; ULN, upper limit of normal; VCTE, vibration-controlled transient elastography; ELF, enhanced liver fibrosis; MRE, magnetic resonance elastography.
ņ╣śļŻī
NAFLDņÖĆ ļŗ╣ļć©ļ│æņØ┤ ĒĢ©Ļ╗ś ļÅÖļ░śļÉśņ¢┤ ņ׳ņØä Ļ▓ĮņÜ░ ņŗ¼ĒśłĻ┤ĆĻ│ä Ļ┤ĆļĀ© ņ¦łĒÖśņØś ņ£äĒŚśļÅäļź╝ ļé«ņČöĻ│Ā ņ£Āļ”¼ ņ¦Ćļ░®ņé░ņØś Ļ░ä ņŗżņ¦ł ņ╣©ņ░®ņØä ņżäņŚ¼ ļŗ©ņł£ ņ¦Ćļ░®Ļ░äņØ┤ ņ¦Ćļ░®Ļ░äņŚ╝ņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņ¦Ć ņĢŖļÅäļĪØ ĒĢśļŖö Ļ▓āņØ┤ ņ╣śļŻīņØś ņ▓½ ļ▓łņ¦Ė ļ¬®Ēæ£ņØ┤Ļ│Ā, NASHĻ░Ć Ļ░äņä¼ņ£ĀĒÖöļĪ£ ņ¦äĒ¢ēĒĢśļŖö Ļ▓āņØä ņżäņ×äņ£╝ļĪ£ņŹ© Ļ░äņĢöņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśļŖö ņ£äĒŚśņØä ļé«ņČöļŖö Ļ▓āņØ┤ ņØ┤ļōżņØä ņ╣śļŻīĒĢśļŖö ļ¬®ņĀüņØ┤ļØ╝ ĒĢĀ ņłś ņ׳Ļ▓Āļŗż[
1,
7].
Fig. 2ļŖö NAFLD ļź╝ ļÅÖļ░śĒĢ£ ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æĒÖśņ×ÉņŚÉņä£ņØś Ļ┤Ćļ”¼ ļ░Å ņ╣śļŻīļź╝ ņ£äĒĢ£ ņĀæĻĘ╝ ļŗ©Ļ│äļź╝ ņÜöņĢĮĒĢ£ ĻČīĻ│ĀņĢłņØ┤ļŗż[
1].
Fig.┬Ā2.
Suggested algorithm for the management of patients with non-alcoholic fatty liver disease (NAFLD) and type 2 diabetes mellitus (T2DM). Adapted from the article of Lee et al. (Diabetes Metab J 2020;44:382-401) [
1] in accordance with the Creative Commons Attribution Non-Commercial (CC BY-NC 4.0) license.

1. ņāØĒÖ£ņŖĄĻ┤ĆņØä ĒåĄĒĢ£ ņ▓┤ņżæ Ļ░Éļ¤ē
ņ▓┤ņżæ Ļ░Éļ¤ēņØĆ ņŗØņØ┤, ņÜ┤ļÅÖĻ│╝ Ļ░ÖņØĆ ņāØĒÖ£ņŖĄĻ┤Ć Ļ░£ņäĀĻ│╝ bariatric surgeryņÖĆ Ļ░ÖņØĆ ņłśņłĀņĀüņØĖ ļ░®ļ▓ĢņØä ĒåĄĒĢ┤ ņØ┤ļŻ©ņ¢┤ņ¦ł ņłś ņ׳ļŗż. Ļ│╝ņ▓┤ņżæ ļśÉļŖö ļ╣äļ¦īĒĢ£ ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æĒÖśņ×ÉĻ░Ć ņ▓┤ņżæņØä Ļ░Éļ¤ēĒĢ£ļŗżļŖö Ļ▓āņØĆ ņŗ¼ĒśłĻ┤ĆĻ│ä ļÅÖļ░śņ¦łĒÖśņØä ņżäņØĖļŗżļŖö Ļ▓ā ņØ┤ņÖĖņŚÉ Ļ░ä ņŗżņ¦łņØś ņ¦Ćļ░® ņČĢņĀüļ¤ēņØä Ļ░Éņåīņŗ£ņ╝£ ņŚ╝ņ”ØĻ│╝ ņØĖņŖÉļ”░ņĀĆĒĢŁņä▒ņØä Ļ░£ņäĀĒĢśļŖö ņØśļ»ĖĻ░Ć ņ׳ļŗż. ņ▓┤ņżæņØä 10% ņØ┤ņāü Ļ░Éļ¤ēĒĢśļ®┤ NAFLD activity score ņØś Ļ░Éņåī, ņ¦Ćļ░®Ļ░äņŚ╝ņØś ĒĢ┤ņåī ļ░Å fibrosis regressionņØä ĻĖ░ļīĆĒĢĀ ņłś ņ׳ļŗż. ņŗØļŗ© ņĪ░ņĀłĻ│╝ ņ£Āņé░ņåīņÜ┤ļÅÖņØś ļ│æĒ¢ēņØ┤ ņäĀĒśĖļÉśĻ│Ā ņ׳ņ£╝ļéś, weight regainņŚÉ ļīĆĒĢ£ ņןĻĖ░Ļ░ä ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ņä£ļŖö Ēśäņ×¼ļĪ£ņä£ļŖö ņĢīļĀżņ¦ä ļ░öĻ░Ć ņŚåļŗż[
7].
2. Ēśłļŗ╣Ļ░ĢĒĢśņĀ£
Peroxisomal proliferator-activated receptor-╬│ (PPAR-╬│) agonistņØĖ thiazolidinedioneņØĆ ņØĖņŖÉļ”░ Ļ░Éņłśņä▒ ĒÜ©Ļ│╝ļź╝ ņ¦Ćļŗłļ®░ Ļ░äņØś ņĪ░ņ¦üĒĢÖņĀü ņåīĻ▓¼ņØä Ē¢źņāüņŗ£Ēé©ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[
8]. ņāØĻ▓Ćņ£╝ļĪ£ NASH ņ¦äļŗ©ņØä ļ░øņØĆ ļŗ╣ļć©ļ│æ ņĀäļŗ©Ļ│ä ļśÉļŖö ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æĒÖśņ×ÉļōżņŚÉĻ▓ī ĒĢśļŻ© ņ╣╝ļĪ£ļ”¼ ņåīļ¬©ļź╝ ņĀ£ĒĢ£ĒĢśĻ│Ā pioglitazoneņØä 18Ļ░£ņøö Ēł¼ņĢĮĒĢśņśĆņØä Ļ▓ĮņÜ░ NASHņØś ĒśĖņĀäņ£©ņØ┤ 51%ņŚÉ ļŗ¼Ē¢łļŗżļŖö ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļÅä ņ׳ņŚłļŗż[
9]. ņ£äĒŚśņä▒Ļ│╝ ņØ┤ļōØņØä Ļ│ĀļĀżĒĢśņŚ¼ pioglitazone ņØä NASHņÖĆ ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æņØ┤ ĒĢ©Ļ╗ś ļÅÖļ░śļÉśņŚłņØä ļĢī ņØ╝ņ░© ņĢĮņĀ£ļĪ£ ņō░ļŖö Ļ▓āņØä Ļ│ĀļĀżĒĢ┤ļ│╝ ņłś ņ׳Ļ▓Āļŗż. Glucacon-like peptide-1 receptor agonist (GLP-1RA)ļŖö insulin ļČäļ╣äļź╝ ņ┤ēņ¦äņŗ£ĒéżĻ│Ā, Ēżļ¦īĻ░ÉņØä ņŻ╝ņ¢┤ ņ▓┤ņżæņØä Ļ░Éļ¤ēņŗ£Ēé┤ņ£╝ļĪ£ņŹ© NAFLDņÖĆ NASHņØś ņ╣śļŻīņĀ£ļĪ£ ļīĆļæÉļÉśĻ│Ā ņ׳ņ£╝ļéś ņŚ░ĻĄ¼Ļ░Ć ļŹö ĒĢäņÜöĒĢ£ ņāüĒÖ®ņØ┤ļŗż[
10]. Sodium-glucose co-transporter 2 (SGLT2) inhibitorsļŖö ņ▓┤ņżæĻ░Éņåīļź╝ ņ£Āļ░£ĒĢ©ņ£╝ļĪ£ņŹ© NAFLDņØś ņ╣śļŻīļź╝ ņ£äĒĢ£ ĒÜ©Ļ│╝ņĀüņØĖ ņĢĮņĀ£ļĪ£ ļČĆņāüĒĢśĻ│Ā ņ׳ļŗż. SLGT2 inhibitorsļŖö Ļ░äĒÜ©ņåī ņłśņ╣śļź╝ Ē¢źņāüņŗ£Ēéżļ®░, Ļ░äņØś ņ¦Ćļ░®ļ¤ē, Ļ░äņØś stiffness ņĀĢļÅäļź╝ ĒśĖņĀäņŗ£Ēé©ļŗżļŖö ņŚ¼ļ¤¼ ņŚ░ĻĄ¼Ļ░Ć ņ׳ņŚłļŗż[
10]. ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æĒÖśņ×ÉņŚÉĻ▓ī Ļ┤æļ▓öņ£äĒĢśĻ▓ī ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŖö 1ņ░© ņ╣śļŻīņĀ£ņØĖ metformin, ĻĘĖļ”¼Ļ│Ā dipeptidyl peptidase-4 (DPP-4) ņ¢ĄņĀ£ņĀ£ņØś Ļ▓ĮņÜ░ NAFLDņÖĆ ļŗ╣ļć©ļ│æ ņé¼ņØ┤ņØś ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ņä£ļŖö ļŹ░ņØ┤Ēä░Ļ░Ć ņČ®ļČäĒĢśņ¦Ć ņĢŖļŗż[
11].
3. ļ╣äĒśłļŗ╣Ļ░ĢĒĢśņĀ£
ņé░ĒÖöņŖżĒŖĖļĀłņŖżļŖö ņ¦Ćļ░®Ļ░äņŚ╝ņØś ņ¦äĒ¢ēņŚÉ ņśüĒ¢źņØä ļü╝ņ╣£ļŗż. ĒĢŁņé░ĒÖöņĀ£ņØĖ vitamin EĻ░Ć Ļ░äņåÉņāüņØä ļ░®ņ¦ĆĒĢśļ»ĆļĪ£ ņāØĻ▓Ćņ£╝ļĪ£ NASH ņ¦äļŗ©ņØä ļ░øņØĆ ļ╣äļŗ╣ļć©ļ│æĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ vitamin Eļź╝ Ēł¼ņŚ¼ĒĢśņśĆņØä ļĢī ņĪ░ņ¦üņåīĻ▓¼ņØś Ē¢źņāüņØä ļ│┤ņØ┤ĻĖ░ļŖö ĒĢśņśĆņ£╝ļéś, ļŗ╣ļć©ļ│æĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ļŹ░ņØ┤Ēä░ļŖö ņŚåņ£╝ļ»ĆļĪ£ ĻČīĻ│ĀĒĢśņ¦ĆļŖö ņĢŖļŖöļŗż[
1]. Statin, ezetimibe, fibrate, niacin, omega-3 polyunsaturated fatty acidļŖö NAFLD ņ¦äļŗ©ņØä ļ░øņØĆ ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æĒÖśņ×ÉļōżņŚÉĻ▓īļŖö ĒÜ©Ļ│╝Ļ░Ć ņ׳ļŗżļŖö ņ”ØĻ▒░Ļ░Ć ņŚåļŗż[
12]. ĒĢŁņé░ĒÖö, ĒĢŁņŚ╝ņ”Ø ņ×æņÜ®ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀż ņ׳ļŖö ursodeoxycholic acid (UDCA)ļŖö NAFLD ņ¦äļŗ©ņØä ļ░øņØĆ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ Ļ░äĻĖ░ļŖź Ē¢źņāü ļ░Å ņ¦Ćļ░®Ļ░äņŚ╝ņØś Ē¢źņāüņØä ļ│┤ņØĖļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ņŚłņ£╝ļéś, NASHņØś Ļ▓ĮņÜ░ ņĪ░ņ¦üĒĢÖņĀüņØĖ ĒśĖņĀäņØä ļ│┤ņØ┤ņ¦ĆļŖö ņĢŖņĢśļŗż. TNF-╬▒ blockerņØĖ pentoxyfyllineņØĆ NASHļĪ£ ĒÖĢņØĖļÉ£ ĒÖśņ×ÉļōżņØś ņĪ░ņ¦üĒĢÖņĀüņØĖ ĒśĖņĀä ņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļéś, ļŗ╣ļć©ļ│æĒÖśņ×ÉĻ░Ć 9.1%ļ░¢ņŚÉ ĒżĒĢ©ļÉśņ¦Ć ņĢŖņØĆ ņŚ░ĻĄ¼ņØś ĒĢ£Ļ│äņä▒ņØ┤ ņ׳ņ¢┤ Ēśäņ×¼ļŖö ņČöņ▓£ļÉśņ¦Ć ņĢŖĻ│Ā ņ׳ļŗż. Nuclear hormoneņØĖ farnesoid X receptorļŖö bile acid ĒĢ®ņä▒ņŚÉ ņŻ╝ņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļ®░ ņ¦Ćļ░®ņØś ļīĆņé¼ņÖĆ insulin sensitivityņŚÉ ņśüĒ¢źņØä ļü╝ņ╣£ļŗż. Farnesoid X receptor activatorņØĖ obeticholic acidļŖö chenodeoxycholic acidņØś ĒĢ®ņä▒ ĒśĢĒā£ņØ┤ļ®░, FLINT trialņŚÉņä£ Ļ░äņāØĻ▓Ćņ£╝ļĪ£ NASH ņ¦äļŗ©ņØä ļ░øņØĆ ĒÖśņ×ÉņŚÉĻ▓ī obeticholic acid Ēł¼ņĢĮĻĄ░ņØś Ļ░ä ņĪ░ņ¦üĒĢÖņĀü ņåīĻ▓¼ņØ┤ Ē¢źņāüļÉśņŚłļŗż. ĒŖ╣Ē׳ ņØ┤ ņŚ░ĻĄ¼ņØś 52.7%Ļ░Ć ļŗ╣ļć©ļ│æĒÖśņ×ÉņśĆļŗżļŖö ļŹ░ņŚÉņä£ ņØśņØśĻ░Ć ņ׳ļŗż. ļ»ĖĒåĀņĮśļō£ļ”¼ņĢäņŚÉņä£ fatty acid transportņØś ņĪ░ņĀłņ×É ņŚŁĒĢĀņØä ĒĢśļŖö carnitineņØĆ ļŗ╣ļć©ļ│æĻ│╝ NAFLD ņ¦äļŗ©ņØä ļ░øņØĆ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ CORONA trialņŚÉņä£ 12ņŻ╝ Ēł¼ņĢĮ ņØ┤Ēøä ALTņØś ĒśĖņĀäĻ│╝ CTļĪ£ ĒīÉļŗ©ĒĢ£ ņ¦Ćļ░®Ļ░äņŚ╝ņØś ĒśĖņĀäņØä ļ│┤ņśĆļŗż[
10,
11].
Ļ▓░ļĪĀ
ļŗ╣ļć©ļ│æņØś ņ£Āļ│æļźĀĻ│╝ ĒĢ©Ļ╗ś ļīĆņé¼ņä▒ ņ”ØĒøäĻĄ░ņØś ņ£Āļ│æļźĀ ņŚŁņŗ£ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. ļŗ╣ļć©ļ│æņØś ņ£äĒŚśņÜöņØĖņØĖ NAFLDņØś ņ£Āļ│æļźĀņØĆ 30%ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░ NAFLDņØś ņ£Āļ│æļźĀņØĆ ļŗ╣ļć©ļ│æņØś ņ£Āļ¼┤ņŚÉ ļö░ļØ╝ 2ļ░░ņØś ņ░©ņØ┤Ļ░Ć ļé£ļŗż. Ļ░äņĪ░ņ¦üņŚÉ ņ¦Ćļ░®ņØ┤ ņČĢņĀüļÉśņ¢┤ ņŚ╝ņ”ØņØ┤ ļ░£ņāØĒĢśĻ│Ā ņŗ¼ĒĢ£ Ļ░äņä¼ņ£ĀĒÖöĻ╣īņ¦ĆļÅä ņØ╝ņ¢┤ļéśļ»ĆļĪ£ NAFLD ņ╣śļŻīņØś ĒĢäņÜöņä▒ņØ┤ ļīĆļæÉļÉśņŚłļŗż. Ļ░ä ņāØĻ▓Ć, ņāØĒÖöĒĢÖņĀüņØĖ ļ░®ļ▓Ģ, ņśüņāüĒĢÖņĀüņØĖ ļ░®ļ▓ĢņØä ĒåĄĒĢ┤ ļŗ©ņł£ ņ¦Ćļ░®Ļ░ä, NAFLD, NASH, ņ¦äĒ¢ēļÉ£ Ļ░äņä¼ņ£ĀĒÖöĻ╣īņ¦Ć ņ¦äļŗ©ņØä ļé┤ļ”┤ ņłś ņ׳Ļ▓ī ļÉśņŚłļŗż. ļŗ╣ļć©ļ│æņØ┤ ļÅÖļ░śļÉśņ¢┤ ņ׳ļŖö NAFLDļź╝ ņ╣śļŻīĒĢ©ņ£╝ļĪ£ņŹ© ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖś ļ░£ņāØļźĀņØä ļé«ņČżĻ│╝ ļÅÖņŗ£ņŚÉ ņ¦Ćļ░®Ļ░äņŚ╝ ļśÉļŖö Ļ░äņä¼ņ£ĀĒÖöļĪ£ņØś ņ¦äĒ¢ēņØä ļ¦ēļŖö ļŹ░ ļ¬®ņĀüņØ┤ ņ׳ļŗż. ņ▓┤ņżæ Ļ░Éļ¤ēņØä ĒżĒĢ©ĒĢ£ ņāØĒÖ£ņŖĄĻ┤Ć ĻĄÉņĀĢņØ┤ Ļ░Ćņן ņżæņÜöĒĢśļ®░, thiazolidinedioneņØ┤ ņØĖņŖÉļ”░ Ļ░Éņłśņä▒ņØä ĒÜīļ│Ąņŗ£ņ╝£ņŻ╝ņ¢┤ Ļ░äņØś ņĪ░ņ¦üĒĢÖņĀü ņåīĻ▓¼ņØś ĒśĖņĀäņØä Ļ░ĆņĀĖņś©ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż. ļŗ╣ļć©ļ│æ ņĢĮņĀ£Ļ░Ć ņĢäļŗī ņŚ¼ļ¤¼ ņĢĮņĀ£Ļ░Ć NAFLD, ņ¦Ćļ░®Ļ░äņŚ╝ņØä ĒśĖņĀäņŗ£Ēé©ļŗżļŖö ņŚ¼ļ¤¼ ļ│┤Ļ│ĀĻ░Ć ņ׳ņ¦Ćļ¦ī, ņĢäņ¦ü ņŚ░ĻĄ¼Ļ░Ć ļŹö ņ¦äĒ¢ēļÉśņ¢┤ņĢ╝ ĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ļŗż.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print